Los resultados, publicados en la revista Molecular Psychiatry (del grupo Nature), demuestran que la presencia de tau en el hipocampo provoca los déficits de memoria, mientras que la acumulación de beta-amiloide en la amígdala desencadena las alteraciones emocionales, como la ansiedad y el miedo, síntomas tempranos de la enfermedad. Además, la combinación de ambas patologías provoca un efecto sinérgico que potencia su impacto en la inflamación y el mal funcionamiento del cerebro.

Históricamente, en el estudio de la enfermedad de Alzheimer (EA) ha habido dos teorías científicas: una que apunta a que todo el proceso patológico se inicia porque se acumula dentro de las células una proteína llamada tau, y otra que señala, en cambio, que es la acumulación de la beta-amiloide lo que desencadena la enfermedad. Este debate ha derivado principalmente en dos enfoques terapéuticos dirigidos a impedir bien la acumulación de la una o bien de la otra, para reducir tanto la sintomatología como el progreso de la enfermedad. El equipo de investigación de este estudio, coordinado por los investigadores Carles Saura y Arnaldo Parra-Damas, del Departamento de Bioquímica y Biología Molecular de la UAB y del INc, sugiere que es necesario un enfoque terapéutico como mínimo dual para poder hacer frente a la enfermedad.
El descubrimiento ha sido posible porque se ha generado un nuevo ratón modelo de la enfermedad. «A pesar de que en los cerebros de las personas que sufren Alzheimer se acumulan ambas proteínas, la mayoría de los modelos animales que se utilizan para estudiar la enfermedad reproducen únicamente una de las dos afectaciones», explica María Dolores Capilla, primera autora del artículo. «En este estudio, sin embargo, hemos generado un ratón transgénico que presenta la doble patología: la acumulación de tau y de beta-amiloide. De este modo hemos podido estudiar sus efectos, tanto por separado como en combinación», añade la investigadora del INc-UAB.
Los hallazgos pueden ser clave para replantear los enfoques terapéuticos actuales, que suelen centrarse en el bloqueo de un solo de estos factores tóxicos. «Los tratamientos actuales no consiguen beneficios clínicos claros. Nuestro estudio indica que una estrategia terapéutica que aborde simultáneamente varios mecanismos fisiopatológicos, como la tau fosforilada y el beta-amiloide, podría ser más efectiva», destaca Carles Saura.
A pesar de que serán necesarios más estudios para confirmar la traslación a humanos, este trabajo es clave de cara a abrir nuevas vías de investigación para el tratamiento de esta enfermedad, señala el equipo de investigación.
Impacto en la transmisión sináptica y la memoria

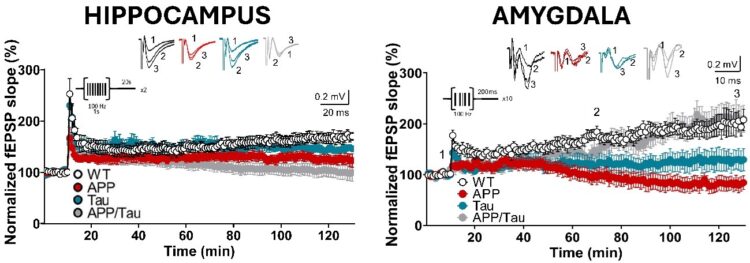
Los investigadores de la Universidad Pablo de Olavide Yuniesky Andrade-Talavera, Irene Martínez Gallego y Antonio Rodríguez-Moreno han contribuido en este hallazgo a entender cómo se ven afectadas la transmisión sináptica basal y la plasticidad sináptica en distintos modelos de EA. Su estudio revela que los déficits tempranos de memoria se asocian con la patología provocada por la proteína tau en el hipocampo (estructura cerebral relacionada con la memoria) en modelos de ratón Tau y APP/Tau. Por otro lado, la ansiedad y el miedo parecen estar vinculados a la presencia intracelular de Aβ en la amígdala (estructura cerebral clave en el aprendizaje y la conducta) en modelos de ratón APP y APP/Tau.
Los registros electrofisiológicos muestran que la forma patológica de tau potencia las alteraciones en el hipocampo en un tipo de plasticidad sináptica conocida como potenciación a largo plazo (LTP), que ya se ve afectada por Aβ. Sin embargo, en la amígdala, tau parece contrarrestar los efectos negativos de Aβ sobre la LTP. Estos hallazgos sugieren que, en las primeras fases de la EA, Aβ y tau actúan de manera sinérgica para alterar la transmisión sináptica en el hipocampo, lo que podría estar vinculado a distintos tipos de deterioro de la memoria según la progresión de la enfermedad.
Dado que ambas proteínas afectan distintos procesos biológicos en la EA, estos resultados subrayan la importancia de desarrollar estrategias terapéuticas dirigidas simultáneamente a múltiples mecanismos patológicos. El estudio también destaca la relevancia del uso de modelos animales en el análisis de enfermedades complejas, permitiendo extrapolar resultados al ámbito humano y desarrollar modelos más precisos para el estudio detallado de patologías como la EA.
El equipo del Laboratorio de Neurociencia Celular y Plasticidad de la UPO se centra en el estudio de la coincidencia temporal de la actividad neuronal y sus ritmos en los procesos de neuroplasticidad, aprendizaje y memoria. Estos aspectos esenciales del procesamiento de la información en el cerebro son analizados tanto en el desarrollo típico del sistema nervioso como en la progresión de la EA.
Referencia:
Capilla-López, M.D., Deprada, A., Andrade-Talavera, Y. et al. Synaptic vulnerability to amyloid-β and tau pathologies differentially disrupts emotional and memory neural circuits. Mol Psychiatry (2025). https://doi.org/10.1038/s41380-025-02901-9
Información elaborada en colaboración con la UAB.